RET融合定义了一类特殊类型的晚期NSCLC患者,尽管卡博替尼和凡德他尼被NCCN指南推荐治疗这部分患者,但由于两款药物存在脱靶效应而导致较大的毒性,且疗效差强人意,因此,临床应用并不普遍。Loxo-292和Blu-667是两款针对RET融合的靶向治疗药物,近期,《Lancet Oncology》在线发表了Blu-667治疗携带RET融合患者的疗效及安全性。
研究背景
RET原癌基因编码跨膜酪氨酸激酶,RET蛋白的激活参与了包括非小细胞肺癌在内的多种实体瘤的发生及发展,该基因融合后产生的蛋白可不依赖于配体的激活而活化,并导致肿瘤的发生和发展。在非小细胞肺癌中,1~2%的患者携带这一突变。早期临床研究评估了多靶点RET抑制剂,包括卡博替尼、凡德他尼及仑伐替尼的疗效,但这些药物只能给患者带来轻微获益,且由于脱靶效应的存在,有较大的不良反应,因此限制了其临床应用。普拉替尼(Blu-667)是一款口服的针对RET融合及突变的酪氨酸激酶抑制剂,临床前模型发现,普拉替尼对RET融合的多种实体瘤具有一定的疗效。本研究旨在评估普拉替尼在RET融合的非小细胞肺癌患者中的疗效及安全性。
这是一项多队列、开放标签的I/II期临床研究,包括I期剂量爬坡以及II期队列扩展。I期剂量爬坡时,纳入年龄大≥18周岁的实体瘤患者,无论RET融合或突变均可入组,而II期队列扩展则基于患者疾病类型及既往治疗线数有所差异。在RET融合的非小细胞肺癌队列,主要纳入经组织或ct-DNA确认的RET融合的非小细胞肺癌患者,而RET突变的患者在另外一组队列,同样允许入组。在研究开始之前,仅允许经治患者入组,随后2019年7月方案修订后,允许无法接受标准治疗的初治患者入组,患者PS评分0~2分。在I期剂量爬坡过程中,患者接受30~600mg,每日一次的口服普拉替尼治疗,随后基于疗效及安全性数据,后续推荐的II期给药剂量为400mg,口服,每日一次。I期的主要研究终点为确定后续的推荐剂量,次要研究终点ORR;II期主要研究终点为ORR,次要研究终点DCR、临床获益率、PFS及OS等。
从2017年3月至2020年5月,共计471例患者入组,其中RET融合的非小细胞肺癌患者233例,92例患者接受过铂类药物治疗,另有29例初治患者,但独立评审委员会发现,6例患者基线无可测量病灶,因此,最终有87例经治和27例初治RET融合的非小细胞肺癌患者纳入本研究。
疗效:经治患者中位治疗线数为2线,ORR为61%,包括6例CR,无论患者融合类型均观察到客观响应,中位至响应出现时间为1.8个月,中位响应持续时间未达到,95%的患者瘤体出现不同程度的缩小。9例患者基线有可测量的脑转移病灶,其中5例患者出现缩小,ORR为56%,包括3例CR患者,6个月和12个月的颅内响应持续率分别为80%和53%(图1)。
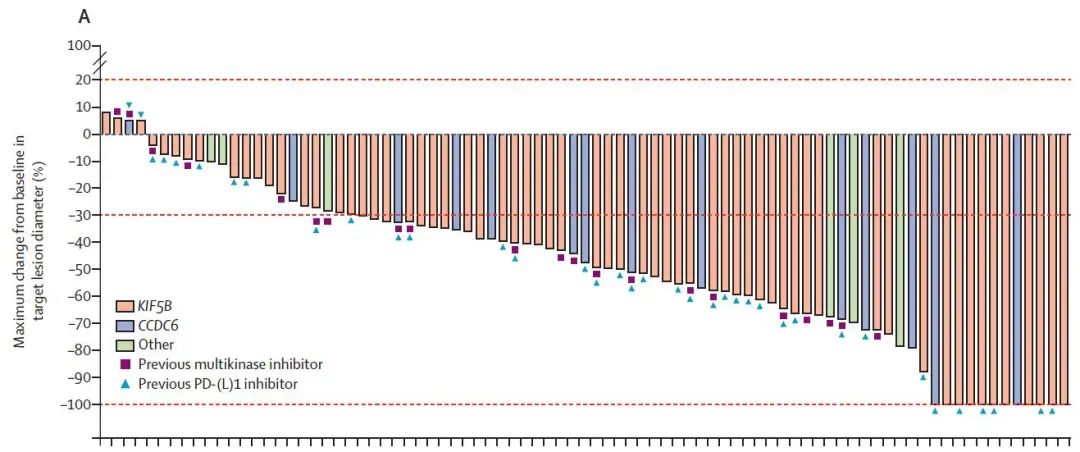
图1 经治患者的ORR
初治的患者的ORR为70%,包括11%的患者出现CR,不同RET融合伴侣均观察到疗效,中位响应持续时间9.0个月,所有患者均观察到瘤体出现不同程度的缩小(图2)。
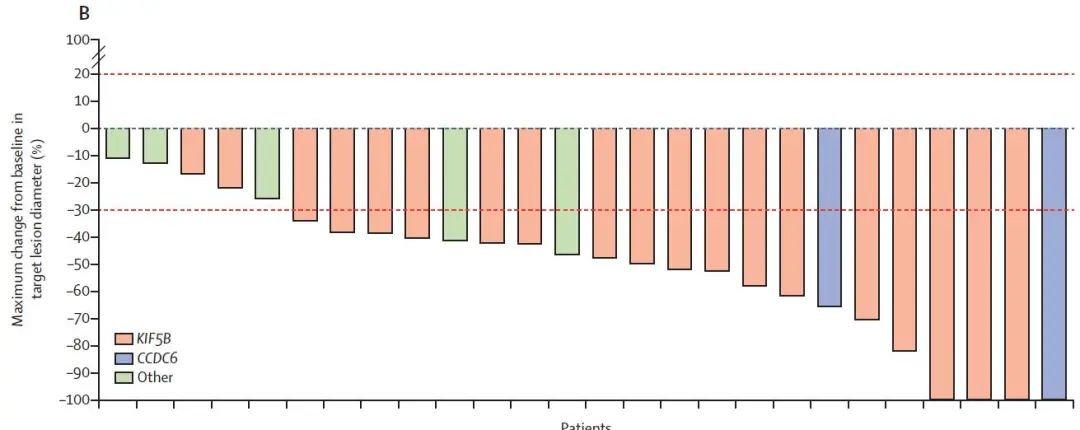
图2 经治患者的ORR
经治患者中位PFS为17.1个月,中位OS尚未达到;初治患者的中位PFS为9.1个月(图3)。
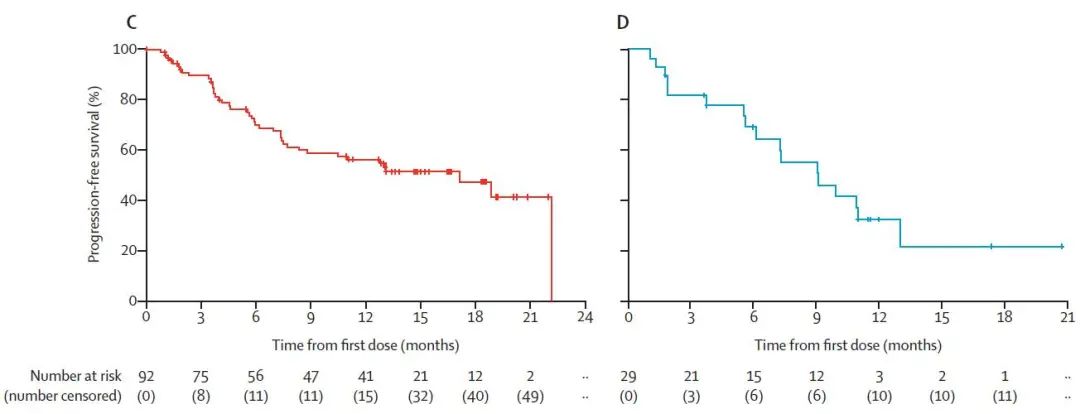
图3 初治和经治患者的PFS
安全性:93%的患者出现任何级别的治疗相关不良反应,其中,3度及以上不良反应发生率为48%,最常见的为中性粒细胞下降18%、高血压11%和贫血10%,严重治疗相关不良反应发生率24%,38%的患者因治疗相关不良反应导致剂量降低,并有6%的患者永久性终止治疗。既往是否接受免疫检查点抑制剂治疗不影响患者安全谱(图4)。
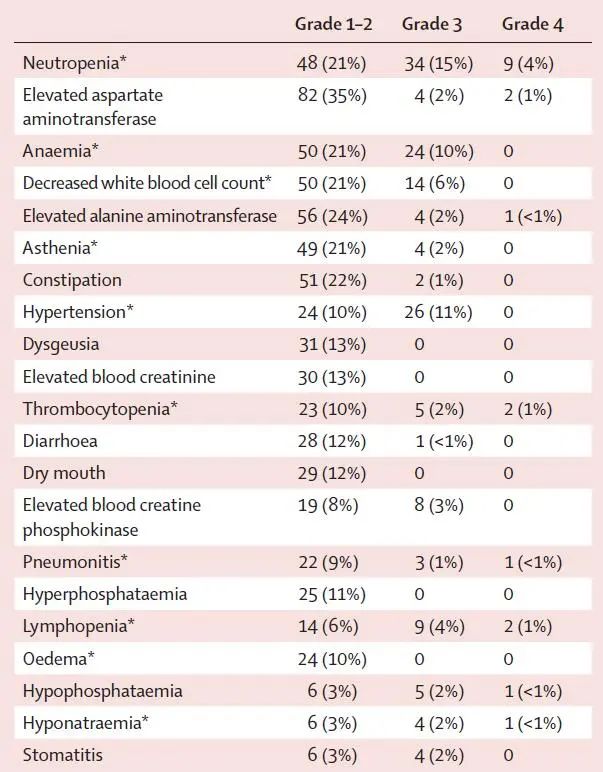
图4 患者的安全性数据
普拉替尼是一款新型耐受性良好的针对RET融合的晚期非小细胞肺癌患者的治疗药物。





 京公网安备 11010502033352号
京公网安备 11010502033352号