编者按:肺癌是当今发病率及死亡率极高一种恶性肿瘤。如古人感叹“行路难,行路难,多歧路,今安在?”,肺癌治疗一度也是如此。幸运的是,以PD-1/L1抗体为代表免疫治疗取得瞩目成就,一经“入世”便破“生存”迷局。“理享氏界”第三期,由上海市胸科医院韩宝惠教授、广东省人民医院张绪超教授主持,四川省肿瘤医院李娟教授,以“乘风”助力非小细胞更长生存周期以及“破浪”小细胞治疗之难,讲解免疫治疗新进展。更有燃石医学张璐博士以PD-L1到TMB突破为题,由表入理,为效价指标以及优势人群甄别,与会专家对相关热点问题进行深入讨论,精彩纷呈。特此整理,以飨读者。
四川省肿瘤医院 李娟教授
近年,肺癌的免疫治疗百花齐放,在NSCLC领域的应用一路披荆斩棘。刚登场时,纳武单抗、阿替利珠单抗和帕博利珠单抗先后在二线较多西他赛取得了生存的优势,顺利取得了二线治疗的适应症。随后研究者发现,尽早使用免疫治疗,可以更好的延长到疾病第二次进展的时间,为免疫治疗从二线走向一线铺就了道路。
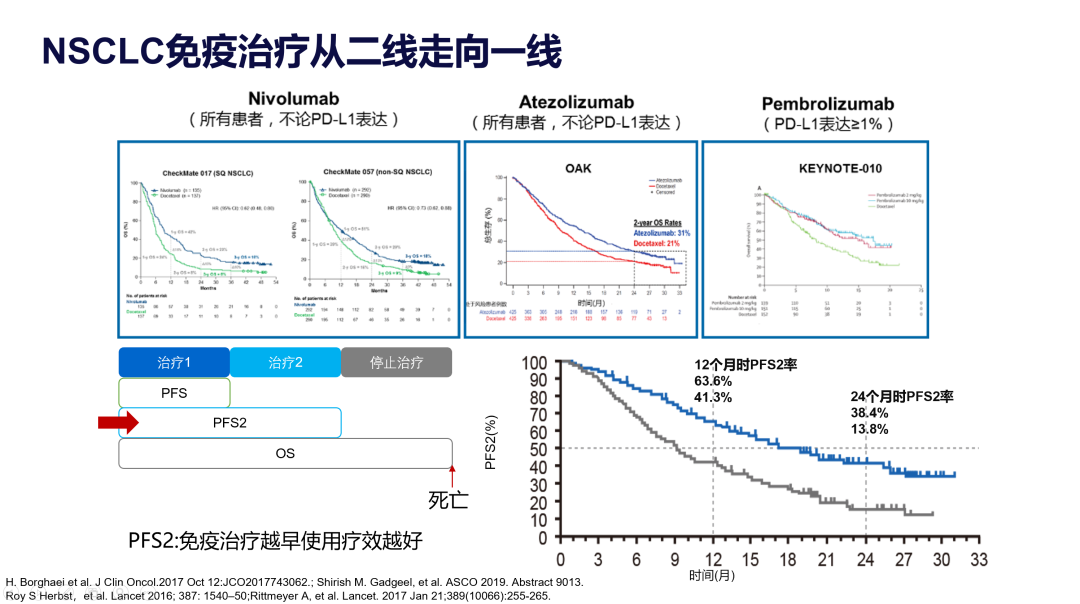
IMpower110研究和KEYNOTE042研究迅速证实了帕博利珠单抗和阿替利珠单抗单药一线用于PD-L1高表达患者可以取得明显获益。然而对于PD-L1低表达的人群,免疫治疗单药并不具备明显优势;同时,在治疗前期,免疫治疗获益并不明显,生存曲线与化疗有明显的重叠。不由令人深思,也许免疫治疗联合其他药物才是真正的出路?KEYNOTE189/407和IMpower130给出了答案,免疫治疗联合化疗一线治疗NSCLC,无论患者PD-L1表达状况如何,均能取得更好的生存获益,且在治疗早期就显示出较化疗更好的治疗效果,从而奠定了一线治疗的基础。在此基础上进一步衍生出IMpower150研究的免疫联合抗血管加化疗方案以及Checkmate9LA 伊匹木单抗联合纳武单抗的双免疫联合化疗方案更是以极其豪华的阵容带来了更好的生存期延长,但随之而来的是不良反应的增加,以及四药联合是否比三药优势更明显的质疑。面对质疑,免疫治疗联合抗血管生成药物隐隐约约开创了豁免化疗的时代,因此,大量的免疫联合治疗研究也在快速推进。
免疫治疗2.0时代,肿瘤微环境的研究更加深入,新的靶点也在不断发掘。CTLA-4抗体会诱导肿瘤PD-L1代偿性过表达,Checkmate227研究印证了此点,纳武单抗联合伊匹木单抗对于PD-L1>1%的患者较化疗或纳武单抗单药可有效改善患者OS,相应的需要关注其不良反应的发生。TGF-β可以诱导新生抗肿瘤T细胞的应答,靶向PD-L1和TGF-β的M7824对PD-L1≥80%的晚期NSCLC患者客观缓解可达85.7%。TIGIT抗体Tiragolumab可以阻断TIGIT与它的配体PVR结合,防止T细胞、NK细胞被抑制。2020年ASCO会上公布的CITYSCAPE研究证实对于PD-L1≥50%的NSCLC患者,一线使用Tiragolumab联合阿替利珠单抗较阿替利珠单抗提高患者ORR。
NSCLC免疫治疗新的靶点不断发展,一路乘风,披荆斩棘。而SCLC则刚刚打开局面,破浪前行。近30年来,SCLC的一线治疗进展缓慢,超过40项大型研究、60个药物的探索不幸铩羽。免疫治疗时代,Checkmate 032 与KEYNOTE 028研究在SCLC三线及以上探索免疫治疗取得初步进展,但Checkmate 451研究中纳武单抗和KEYNOTE 604研究中帕博利珠单抗在SCLC的一线探索双双失利。所幸,IMpower 133中阿替利珠单抗打破藩篱,在ES-SCLC患者的一线治疗中联合化疗较化疗降低30%的死亡风险,一举成为30年来改变指南的免疫治疗破局者。研究的脚步不止于此,CASPIAN研究中德瓦鲁单抗联合化疗一线治疗ES-SCLC降低27%死亡风险,再次证实了IMpower133的结果。未来,更多免疫治疗联合模式不断探索,放疗联合免疫的研究正在进行,肺癌免疫治疗不再是“多歧路”,我们正乘风破浪,直挂云帆济沧海。
韩宝惠教授:NSCLC一线免疫治疗选择越来越多,如联合化疗,免疫,抗血管等。对于中国患者,临床如何去选择未来免疫联合治疗方案?
李娟教授:目前我们对肿瘤的了解尚不够深入,常用的生物标志物仅有PD-L1和TMB,虽然当前诸多新兴的免疫靶点正在发展,但研究仍多集中在PD-L1高表达人群,很难会有一个双免疫方案独步天下。我们需要对肿瘤的免疫表型进一步细分,以期提供相应的联合方案,比如免疫治疗的4药联合方案并不适合所有患者,大病灶患者可能更适合此种方案;免疫联合抗血管生成药物则对脑转移患者也有更好的表现,但这仅仅为基于临床特征的选择,我们仍需要更加深入的探索。
韩宝惠教授:PD-1抑制剂(Checkmate 331/451和KEYNOTE 604)临床试验接连报出阴性结果,而PD-L1(IMpower 133/CASPAIN)相继达到临床研究终点。是临床实验设计还是药物作用机制带来了这样的结果?
张绪超教授:一方面, PD-1与PD-L1作用机制不同。PD-1抑制剂可以阻断PD-1与PD-L1和PD-L2结合,于是额外带来PD-L2与RGMB结合,从而活化T细胞;而PD-L1在阻断PD-1与PD-L1结合的同时,也会阻断抗原呈递细胞表面PD-L1与CD80的结合,引发CD80与CTLA4结合,从而抑制T细胞。貌似PD-1抑制剂的作用更强,但更多研究显示PD-L1更加成功,从机制上并不能完全得到合理的解释。另一方面,免疫治疗的临床研究设计并不完善:第一,免疫抑制剂的剂量远超其占据所有受体所需剂量,不必要的大剂量可能带来了疾病进展;第二,免疫治疗的药物使用时间并无统一标准;第三,临床终点的设计不合理,虽然KEYNOTE604研究报出阴性结果,但其2年OS率非常可观,所以免疫治疗的临床设计是否需要优化仍未可知。
?
韩宝惠教授:如何看待免疫治疗时长?一年 or 两年还是一直使用到疾病进展?
李娟教授:这是一个难以回答,又是不得不面对的问题。从个人经验来讲,首先要区分患者是否CR,CR患者无肿瘤负荷,可以考虑2年后停药;而非CR患者,既往研究显示早期停药患者复发风险较高,所以应考虑继续用药,但可能会考虑适当延长给药间隔,以求疗效和毒性的平衡。
张绪超教授:既往研究显示免疫治疗1年以上效果优于小于1年的患者,所以1年并不是很好的停药时机;另外对长期用药患者,我同意李娟教授的观点,可以考虑对CR患者停药,对非CR患者,长期免疫抑制可能会对患者产生更多不良反应,可以考虑降低剂量强度,足够覆盖患者所有受体即可,但仍需要进一步的研究证实。
燃石医学 张璐博士
免疫检查点抑制剂在不同肿瘤领域已取得长足进步,几乎所有肿瘤患者均可从中获益,但对患者无选择的给药可能会对无效患者带来不必要的伤害,所以精准的选择患者是免疫治疗亟需解决的问题。
目前国内外证据级别最高的免疫治疗肿瘤标志物是PD-L1,2019年 NCCN NSCLC指南已将PD-L1检测作为1类推荐。但PD-L1远不能满足当前需求,基于基因组信息的标志物探索进入了研究者的视野,TMB以简单数值反映肿瘤基因组变化全貌的指标成为了理想的肿瘤标志物。早在2015年,KEYNOTE-001研究就显示了NSCLC中TMB高表达患者免疫治疗的获益更多。究其原因,可能是TMB-H患者伴有更多的DNA损伤修复通路的突变。于是研究者迅速开启了基于TMB原理的免疫治疗人群选择研究,在不同的肿瘤中,微卫星不稳定高(MSI-H)的患者往往意味着更高的TMB,从而进一步证实了MSI-H患者可以从免疫治疗中取得更佳的生存获益。因此,MSI成为首个FDA批准的不区分阻止来源的免疫治疗生物标志物。
在Checkmate 026研究失败之际,对患者进行基于TMB的区分后发现了TMB-H患者获益更佳。随后,Checkmate 568研究确定了TMB界值为≥10mut/Mb。于是研究者修改了Checkmate 227的研究设计,对NSCLC双免疫治疗新增了主要研究终点,即基于TMB选择人群的PFS表现,并以10mut/Mb为界值。最终结果显示TMB-H人群,无论PD-L1状态如何,双免疫疗效较化疗能显著延长患者PFS。因此,TMB作为NSCLC良好的预测因子于2019年被首次写入NCCN指南。
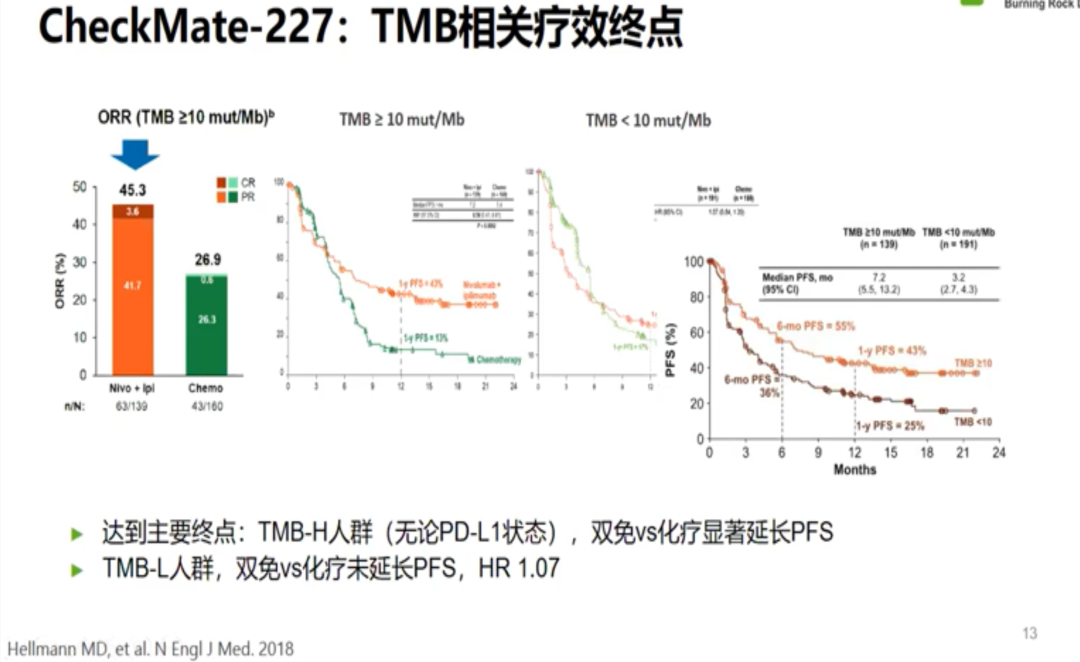
但最终在Checkmate227研究亚组中,无论TMB高低,NSCLC一线双免疫治疗的OS均优于化疗,无法证实TMB-H人群双免疫治疗较TMB-L的优势,以TMB-H为基础申请FDA适应症的期望无奈折戟沉沙。不久之后,KEYNOTE158研究带来了新的希望,该研究以也10mut/Mb为界值,取得了十分优秀的ORR表现,因此帕博利珠单抗被FDA批准后线用于TMB-H的肿瘤患者。
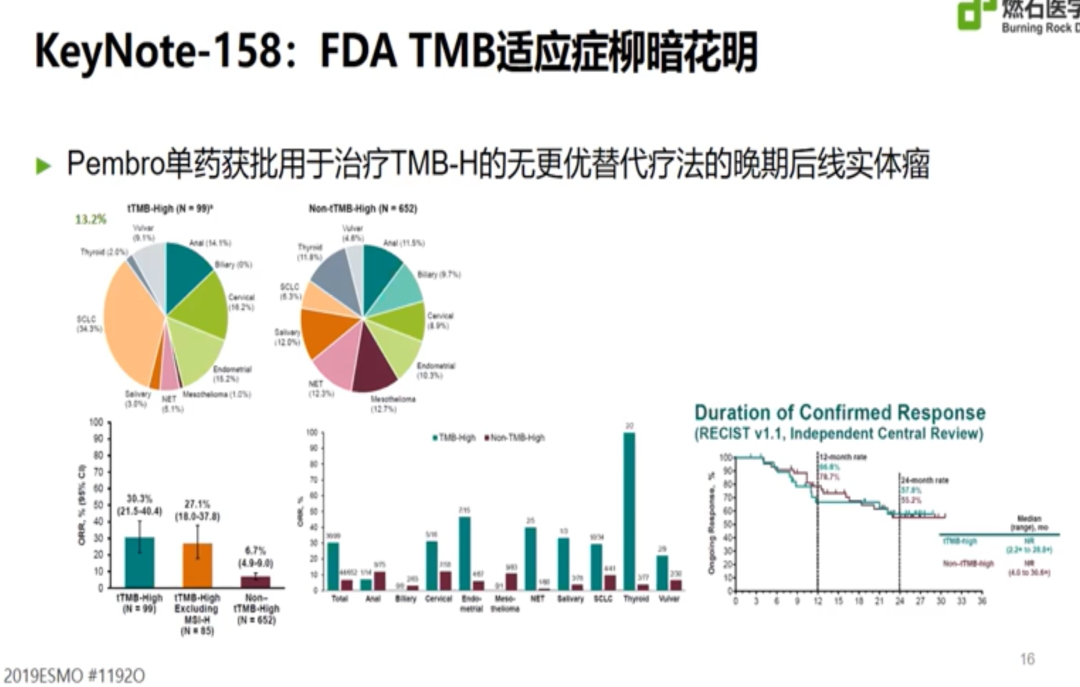
需要明确的是,Checkmate 227研究采用FoundationOne(v3.3)算法计算的TMB值,与KEYNOTE158研究的算法不一定相同,二者的界值是否可以互换仍未可知。而目前全球不同实验室进行的TMB检测Panel、覆盖基因数、覆盖范围和TMB区域也不尽相同,如何实现TMB检测标准化,也是迫在眉睫的问题。
目前,已有两项临床研究对不同平台TMB检测标准化的协调进行了初步尝试。FOCR研究已经完成了第一阶段,对作为参比标准的 TCGA WES算法给出了明确定义;2020年对2B阶段15家实验室的临床样本进行了标准化和一致性的初步设定,目前仍在探索当中,期待其第三阶段临床验证的结果尽快发表以指导临床。QUIP研究则显示,在严格的质控下,不同实验室不同Panel的差异较小,大Panel与WES的TMB分类一致性也相对较好,但尚不完美。其中对TMB评分的影响因素包括假阳性、DNA投入量、测序深度、基因组的覆盖以及突变丰度的cut-off等。国内TMB检测的标准化之路也充满坎坷。我们迫切需要统一的监管机构或独立的学术机构来组织各方参考FOCR的流程建立统一的评价标准,最终进行有效的临床验证。
TMB作为单一生物标志物同样并不完美,既往研究显示免疫治疗生存最长的患者并非单纯TMB最高的患者,往往是TMB较高且PD-L1高表达的患者。更多研究也显示TMB和PD-L1是两个相对独立的预后因素,TMB能够提示肿瘤的免疫原性,但无法提示是否产生了抗肿瘤免疫应答。所以,联合TMB和PD-L1的检测,有可能及进一步优化对免疫治疗患者人群的选择,KEYNOTE010与KEYNOTE042 研究也证实了在PD-L1阳性患者引入TMB分层后,对免疫治疗具有更好预测价值。
同样的,也有证据显示基因组拷贝数变异、特定基因变异(如STK11、KEAP1等)与TMB的联合也可能提高预测性能,但需要更多的临床数据验证。此外,肿瘤基因的突变类型,肿瘤的克隆性,肿瘤的异质性也会影响免疫原性和免疫治疗效果,在临床预测中往往需要特别注意。
TMB已成为后线肿瘤免疫治疗的优秀生物标志物,但其检测的标准化、规范化仍存在诸多挑战,对TMB的预测价值仍有更多的优化手段值得探索。在这百步九折萦岩峦的道路上,必有更多以手抚膺的美景。
韩宝惠教授:TMB检测应如何规范的应用于临床实践,临床中应如何选择Panel、算法等?
张璐博士:我们希望能通过取样的突变密度反映基因组的突变密度,若取样太小,则可能对编码区突变密度估值偏高。目前的初步的共识要求Panel对编码区的覆盖要达到1Mb左右,FoundationOne是现有对编码区覆盖最小的Panel,为0.8Mb。所以我们不仅要求Panel的取样基因数目多,也要求整体覆盖范围满足要求。
而对于TMB检测的标准化,我国官方机构也在进行相应的尝试,希望能够尽快的有统一的质控标准,以期各检测机构与之对齐。这不仅仅需要机构进行性能验证,也需要继续临床验证。最终才能与特定药物绑定,对免疫治疗药物产生明确的疗效预测价值。
?
韩宝惠教授:与tTMB相比,bTMB的临床应该可能更具优势,临床应用应注意什么?
张璐博士:当前bTMB应用最大的阻力在于敏感性,若ctDNA浓度太低,则无法有效评估bTMB,因此,如何设置有效的评估标准指导临床是存在困难的。另外,ctDNA丰度是免疫治疗独立的预后因素,其对bTMB的影响也需要纳入临床实践的考量中。
?
张绪超教授:肺癌免疫治疗除已批准的biomarker,还有哪些标志物可能走向临床?
韩宝惠教授:目前TMB更广义的概念是新抗原,内涵十分丰富,未来对新抗原的进一步细分可能是生物标志物的筛选方向。另外,免疫治疗的本质是释放T细胞免疫活性,解除免疫抑制。未来对T细胞的受体如HLA、TCR的亚型的探索可能会带来更多的生物标志物。
张璐博士:肿瘤微环境标志物GEP或γ-干扰素相关信号通路也许会有一定发展空间,肿瘤微环境是当前比较热门的研究话题,基于现有技术,对GEP检测的标准化和量化相对更容易实现,更令人期待。
肺癌的免疫治疗正乘风破浪,免疫治疗预测的靶点也在披荆斩棘,纵有扪参历井的险阻,纵有百步九折的坎坷,在免疫治疗的新时代,以有效的生物标志物筛选患者,以合理的治疗策略改善生存,我们终将在抗击肺癌的长河中,长风破浪会有时,直挂云帆济沧海。





 京公网安备 11010502033352号
京公网安备 11010502033352号